Рабочая Программа По Химии 11 Класс Рудзитис 2 Часа
Программа рассчитана на 70 часов (2 часа в неделю, 1 час добавлен за счет. Рудзитис Г.Е., Фельдман Ф.Г., Химия. Основы общей химии. Количество часов: всего – 35, в неделю – 1 час. Рабочая программа составлена по программам общеобразовательных учреждений по химии ( автор Гара Н.Н.) для 8-9, 10-11 классов, издательства «Просвещение». Г.Е.Рудзитис, Ф.Г.Фельдман.
- Рабочая Программа По Химии 11 Класс Рудзитис 2 Часа В Неделю
- Рабочая Программа По Химии 10-11 Класс Рудзитис 2 Часа
- Рабочая Программа По Химии 11 Класс Рудзитис 2 Часа
Муниципальное образовательное учреждение «Средняя общеобразовательная школа № » РАССМОТРЕНО на заседании МО учителей Протокол от«» 2010 г. № СОГЛАСОВАНО заместитель директора МОУ «СОШ №» ФИО (подпись) РАССМОТРЕНО на заседании педагогического совета Протокол от «» 2010 г. № УТВЕРЖДАЮ Директор МОУ «СОШ №» ФИО (подпись) ^ РАБОЧАЯ ПРОГРАММА по химии 11 класс (базовый уровень) автор-составитель (составитель, автор) Ф.И.О Старый Оскол 2010 Пояснительная записка Данная рабочая программа по химии для 11 класса разработана на основе авторской программы О.С. Габриеляна, соответствующей федеральному компоненту государственного стандарта общего образования (базовый уровень), утвержденному приказом № 1312 Министерства образования РФ от г., и допущенной Министерством образования и науки Российской Федерации к использованию в образовательных учреждениях. (Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений /О.С. – 3-е изд., стереотип.
Рабочая программа по химии 8-9. 9 класс из расчёта 2 часа.
– М.: Дрофа, 2006).
Предмет: Класс: УМК: Количество часов: Химия 11 Г.Е. Рудзитиса, Ф.Г. Фельдмана 68 Пояснительная записка Настоящая программа раскрывает содержание обучения химии учащихся в 11 классах общеобразовательных учреждений. Программа составлена на основе программы курса химии для 10-11 классов общеобразовательных учреждений (базовый уровень) автора Н. Гара ( Гара Н.Н. Программы общеобразовательных учреждений. Химия.- М.: Просвещение, 2008).
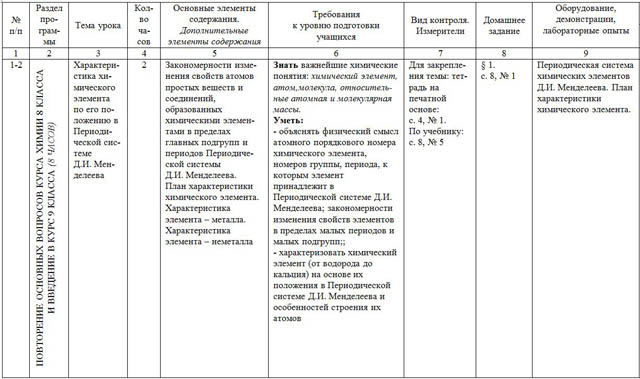
Материал соответствует требованиям федерального компонента Государственного стандарта общего образования 2004 года. Тема Кол-во часов Основная цель Раздел 1.Теоретические основы химии Тема 1. Важнейшие химические понятия и законы 31 3 Повторить и систематизировать знания учащихся о ранее изученных теориях и законах химической науки: законе сохранения массы веществ, законе постоянства состава; повторить основные химические понятия: «атом», «химический элемент», «изотопы», «простое вещество», «сложное вещество» Тема 2. Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атомов 6 Систематизировать и углубить знания по строению атома и периодического закона, изучить положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов, валентные возможности атомов Тема 3.
Строение вещества 9 Систематизировать и углубить знания о видах химической связи, типов кристаллических решёток, основных способов выражения концентрации растворов Тема 4. № п/п Наименование раздела и тем Часы учебного времени Плановые сроки прохожде ния Фактические сроки прохождения Примечание демонстрации, лабораторные опыты 1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИИ Важнейшие химические понятия и законы Вводный инструктаж по ТБ. Химический элемент. Простые и сложные вещества.
4 1 2.09.13 2 Закон сохранения и превращения массы и энергии при химических реакциях. 1 5.09.13 3 Закон постоянства состава, вещества молекулярного и немолекулярного строения. 1 9.09.13 4 Решение задач и упражнений 1 12.09.13 5 Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атомов Атомные орбитали, s -, p -, d -, f -электроны. Особенности размещения электронов по орбиталям в атомах малых и больших периодов. Энергетические уровни и подуровни 5 1 16.09.13 6 Связь периодического закона и периодической системы химических элементов с теорией строения атомов.
Короткий и длинный варианты таблицы химических элементов 1 19.09.13 7 Положение в периодической системе химических элементов Д.И.Менделеева водорода, лантаноидов, актиноидов и искусственно полученных элементов 1 23.09.13 8 Валентность и валентные возможности атомов. Периодическое изменение валентности и размеров атомов. 1 26.09.13 9 Контрольная работа №1 по темам: « Теоретические основы химии. Периодический закон и периодическая система химических элементов Д.И.Менделеева на основе учения о строении атомов» 1 30.09.13 10 Строение вещества Виды и механизмы образования химической связи. Ионная связь. Катионы и анионы. Ковалентная неполярная связь.
Ковалентная полярная связь 9 1 3.10.13 11 Характеристики химической связи. Пространственное строение неорганических и органических веществ и химической связи 1 7.10.13 12 Типы кристаллических решёток и свойства веществ. 1 10.10.13 Д.Модели ионных, атомных, молекулярных и металлических кристаллических решеток.
Рабочая Программа По Химии 11 Класс Рудзитис 2 Часа В Неделю
Эффект Тиндаля. Модели молекул изомеров, гомологов. 13 Причины многообразия веществ: изомерия, гомология, аллотропия, изотопия.
1 14.10.13 14 Дисперсные системы. Истинные растворы. Коллоидные растворы.
Капли краски очень большие, трудно добиться равномерности покрытия, а срок его сушки чрезмерно большой. Покраска молотковой эмалью 'бронза' оказалась неудачной. Прошивку на простые часы на микроконтроллере avr. Даже через две недели сушки на покрытии оставались следы от прикосновений. Как оказалось, она и выглядит неплохо, можно даже оставить так.
1 17.10.13 15 Способы выражения концентрации растворов: массовая доля растворённого вещества, молярная концентрация. 1 21.10.13 16 Инструктаж по ТБ Практическая работа №1 « Приготовление растворов с заданной молярной концентрацией». 1 24.10.13 17 Вычисление массы, количества вещества, объема продукта реакции, если для его получения дан раствор с определенной массовой долей исходного вещества. 1 28.10.13 18 Решение расчётных задач. Тест по теме: «Строение вещества» 1 31.10.13 19 Химические реакции Классификация химических реакций в неорганической и органической химии. 13 1 11.11.13 20 Окислительно-восстановительные реакции 1 14.11.13 21 Скорость реакции, её зависимость от различных факторов.
Рабочая Программа По Химии 10-11 Класс Рудзитис 2 Часа
Закон действующих масс. Энергия активации. 1 18.11.13 Д.Зависимость скорости химической реакции от концентрации и температуры. 22 Инструктаж по ТБ. Практическая работа № 2 «Влияние различных факторов на скорость химической реакции». 1 21.11.13 23 Катализ и катализаторы. Обратимость химических реакций.
1 25.11.13 Д.Разложение пероксида водорода в присутствии катализатора. 24 Химическое равновесие. Смещение равновесия под действием различных факторов. Принцип Ле-Шателье. 1 28.12.13 25 Производство серной кислоты контактным способом.
1 2.12.13 26 Электролитическая диссоциация. Сильные и слабые электролиты. Кислотно-основные взаимодействия в растворах. 1 5.12.13 Л.О.
Рабочая Программа По Химии 11 Класс Рудзитис 2 Часа
«Проведение реакций ионного обмена для характеристики свойств электролитов» 27 Гидролиз органических и неорганических соединений. 1 9.12.13 28 Составление уравнений гидролиза органических и неорганических соединений. 1 12.12.13 29 Среда водных растворов: кислая, нейтральная, щелочная. Ионное произведение воды.
Водородный показатель (рН) раствора. 1 16.12.13 Д.Определение среды раствора с помощью универсального индикатора. 30 Обобщение по теме «Химические реакции». Вычисления массы продукта реакции, если известна масса исходного вещества, содержащего определенную долю примесей 1 19.12.13 31 Контрольная работа № 2 по теме: «Химические реакции» 1 23.12.14 32 НЕОГРАНИЧЕСКАЯ ХИМИЯ Металлы Анализ результатов контрольной работы.

Положение металлов в периодической системе химических элементов Д.И.Менделеева. 14 1 26.12.14 Л.О. «Знакомство с образцами металлов и их рудами». 33 Повторный инструктаж по ТБ.
Общие свойства металлов. Электрохимический ряд напряжений металлов 1 13.01.14 34 Общие способы получения металлов. 1 16.01.14 35 Электролиз растворов и расплавов веществ 1 20.01.14 36 Понятие о коррозии металлов. Способы защиты от коррозии. 1 23.01.14 37 Обзор металлов главных подгрупп периодической системы химических элементов ( I и II группы). 1 27.01.14 38 Обзор металлов главных подгрупп периодической системы химических элементов( III группы). 1 30.01.14 39 Обзор металлов побочных подгрупп периодической системы химических элементов (медь, цинк, титан) 1 3.02.14 Л.О.
«Взаимодейст вие цинка и железа с растворами кислот и щелочей». 40 Обзор металлов побочных подгрупп периодической системы химических элементов (хром, железо, никель, платина) 1 6.02.14 41 Сплавы металлов. 1 10.02.14 42 Оксиды и гидроксиды металлов. 1 13.02.14 43 Расчеты по химическим уравнениям, связанные с массовой долей выхода продукта реакции от теоретически возможного. 1 17.02.14 44 Обобщение по теме: «Металлы» 1 20.02.14 45 Контрольная работа №3 по теме: «Металлы» 1 24.02.14 46 Неметаллы Анализ результатов контрольной работы. Обзор свойств неметаллов.
Строение и свойства простых веществ – неметаллов. 10 1 27.02.14 Д.Ознакомле- ние с образцами неметаллов Л.О. «Знакомство с образцами неметаллов и их природными соединениями». 47 Окислительно-восстановительные свойства типичных неметаллов. Горение серы, фосфора, железа, магния в кислороде. 48 Оксиды неметаллов 1 6.03.14 Д. Образцы оксидов неметаллов и кислородсодержащих кислот 49 Кислородсодержащие кислоты 1 10.03.14 50 Окислительные свойства азотной кислоты 1 13.03.14 51 Окислительные свойства серной кислоты 1 17.03.14 52 Водородные соединения неметаллов 1 20.03.14 53 Решение задач и упражнений 1 3.04.14 54 Обобщение по теме: «Неметаллы» 1 7.04.14 Л.О.
«Распознавание хлоридов, сульфатов, карбонатов». 55 Контрольная работа №4 по теме: «Неметаллы» 1 10.04.14 56 Генетическая связь неорганических и органических веществ. Практикум Анализ результатов контрольной работы. Генетическая связь неорганических веществ 13 1 14.04.14 57 Генетическая связь органических веществ. 1 17.04.14 58 Генетическая связь неорганических веществ и органических веществ 1 21.04.14 59 Инструктаж по ТБ Практическая работа №3 « Решение экспериментальных задач по неорганической химии».
1 24.04.14 60 Инструктаж по ТБ Практическая работа №4 « Решение экспериментальных задач по органической химии». 1 28.05.14 61 Инструктаж по ТБ Практическая работа №5 «Решение экспериментальных задач по теме «Металлы и неметаллы». 1 1.05.14 62 Инструктаж по ТБ Практическая работа № 6 «Получение, собирание и распознавание газов». 1 5.05.14 63 Бытовая химическая грамотность 1 8.05.14 64 Решение расчётных задач по неорганической химии 1 12.05.14 65 Решение расчётных задач по органической химии 1 15.05.14 66 Обобщение по курсу химии. 1 19.05.14 67 Итоговая контрольная работа 1 22.05.14 68 Анализ результатов контрольной работы 1 24.05.14 8.Описание материально-технического обеспечения образовательного процесса Основная литература 1.
Программы общеобразовательных учреждений. 10-11 классы – М.: Просвещение», 2008 2. Рудзитис Г.Е. Химия: основы общей химии: учебник для 11 кл. Учреждений: базовый уровень/ Г.Е. Рудзитис, Ф.Г.Фельдман.
Тп 903-3-03с. 91. Типовые проектные решения 903-3-03с.91 Баки-аккумуляторы. ТИПОВОЙ ПРОЕКТ.
М.: Просвещение, 2009 Дополнительная литература 1. Карты - инструкции для практических занятий по химии: методическое пособие для учащихся 8-11 классов. Оскол.: ИПК «Квадрат», 2004 2. Горбунцова С.
«Тесты и ЕГЭ по основным разделам школьного курса: 10-11классы» – М.: «ВАКО», 2006 3. Каверина А.А. ЕГЭ 2010.Химия Федеральный банк экзаменационных материалов/Ав.сост.А.А.Каверина, Ю.И.Медведев,Д.Ю.Добротин. – М.: Эксмо, 2010 4. Корощенко А.А.Самое полное издание типовых вариантов реальных заданий ЕГЭ:2009. Химия /авт-сост.А.А.Корощенко,М.Г.Снастина - М.: АСТ:Астрель,2009 5. Радецкий А.М., Горшкова В.П., Кругликова Л.Н.
Дидактический материал по химии для 10 классов: пособие для учителя. – М.: Просвещение, 2008. Третьяков Ю.Д.
Справочные материалы. Книга для учащихся. М.: Просвещение, 1993 7.
Хомченко И.Г. Сборник задач и упражнений для средней школы.
– М.: «Издательство Новая Волна», 2009 MULTIMEDIA – поддержка предмета Виртуальная школа Кирилла и Мефодия. 10-11 классы. – М.: ООО «Кирилл и Мефодий», 2008 Оборудование 1.Набор химических реактивов. Серия таблиц Правила работы в химической лаборатории Основные приёмы работы в химической лаборатории Обращение с различными веществами Название кислот и солей Типы кристаллических решёток Соотношение между видами химической связи. Химическая связь Растворимость солей, кислот и оснований в воде Генетическая связь между классами соединений Ионная связь Ковалентная связь Растворимость солей, кислот и оснований в воде Распространение атомов элементов в природе Атомные радиусы элементов 1-4 периодов Периодическая система химических элементов Д.И. Менделеева Электроотрицательность химических элементов Строение атома углерода Электролиз в металлургии Гидролиз водных растворов солей Ряд напряжений металлов Образование водородной связи 3. Набор коллекций.
Вид контроля Название темы Контрольная работа №1 Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. Установите соответствие между химической формулой соединения и значением степени окисления серы в нем. ФОРМУЛА СОЕДИНЕНИЯ СТЕПЕНЬ ОКИСЛЕНИЯ СЕРЫ A ) Mg ( HS 0 4 ) 2 1)0 Б ) А 1 2 S 3 2)+2 B)S 8 3)+4 Г )(NH 4 ) 2 SO 3 4)+6 5)-2 С1. Вычислите массу соли и объём газа, который выделится при взаимодействии цинка с 150 г 20% соляной кислотой.
Контрольная работа №1 по теме: « Важнейшие химические понятия и законы. Периодический закон и периодическая система химических элементов Д. Строение вещества» Вариант 2. Иону S 2- соответствует электронная формула 1) ls 2 2 s 2 2 p 6 3 s 2 3 p 6 2) ls 2 2 s 2 2 p 6 3 s 2 3 p 4 3) ls 2 2 s 2 2 p 6 4) ls 2 2 s 2 2 p 6 3 s 2 3 p 2 А2. Число нейтронов в ядре атома 39 К равно 2)20 3)39 4)58. А3.
Химический элемент расположен в четвертом периоде, в IA группе. Распределению электронов в атоме этого элемен- та соответствует ряд чисел 1)2,8,8,2 3)2,8,8,1 2)2,8,18,1 4)2,8,18,2 А4. В ряду химических элементов Na - Mg - Al – Si увеличивается число валентных электронов в атомах уменьшается число электронных слоев в атомах уменьшается число протонов в ядрах атомов увеличиваются радиусы атомов А5. Вещества, имеющие молекулярную кристаллическую решётку, как правило: 1) тугоплавки и хорошо растворимы в воде 2)легкоплавки и летучи 3) твёрды и электропроводны 4)теплопроводны и пластичны В1. Установите соответствие между формулой частицы и её электронной конфигурацией Частица электронная конфигурация А) S 0 1) 1 s 2 2 s 2 2 p 6 3 s 2 Б ) Cl +7 2) 1s 2 2s 2 2p 6 3s 2 3p 4 В ) Р +3 3) 1s 2 2s 2 2p 5 Г) N -2 4) 1 s 2 2 s 2 2 p 6 В2. Установите соответствие между веществами и типом химической связи в них Cl 2; А) металлическая; Fe; Б) ковалентная полярная; NO; В) ковалентная неполярная; MgO; Г) ионная С1. Рассчитайте массовую долю соли в растворе, полученном при растворении 1,3 г цинка в 36,5 г 10% раствора соляной кислоты.
Ключи к проверке 1 вариант. Баллы 1-5 6-8 9-10 11-12 Отметка «2» «3» «4» «5» Контрольная работа №2 по теме «Химические реакции» Вариант1. Реакция, уравнение которой CaCO 3 (к) = CaO (к) + CO 2 (г) – Q, относится к реакциям 1) соединения, экзотермическая 2) разложения, эндотермическая 3) соединения, эндотермическая 4) разложения, экзотермическая А2. Сокращенное ионное уравнение реакции Al 3+ + 3 OH – = Al ( OH ) 3 соответствует взаимодействию 1) хлорида алюминия с водой 2) алюминия с водой 3) хлорида алюминия со щелочью 4) алюминия со щелочью А3. Какой из факторов не оказывает влияния на скорость химической реакции в растворах? 1) концентрация веществ 2) использование катализатора 3) использования ингибитора 4) объём реакционного сосуда А4.
Химическое равновесие в системе 2NO (г) + O 2 (г) ↔ 2NO 2 (г) + Q смещается в сторону образования продукта реакции при. НАЗВАНИЕ СОЛИ ОТНОШЕНИЕ К ГИДРОЛИЗУ А) фосфат калия 1) щелочная Б) сульфат меди 2) кислая В) карбонат лития 3) нейтральная Г) нитрат натрия В2. В соответствии с термохимическим уравнением реакции С(тв) + О 2 (г) = СО 2 (г) + 393,3 кДж при выделении 1180,9 кДж теплоты масса сгоревшего углерода равна г. (Запишите число с точностью до целых) С1. Используя метод электронного баланса, составьте уравнение реакции: КМ nO 4 → К 2 М nO 4 +.+.
Определите окислитель и восстановитель. Вычислите объём углекислого газа, который образуется при разложении 300 г карбоната кальция, содержащего 10% примесей. Контрольная работа №2 по теме «Химические реакции» Вариант2. Реакция горения аммиака 4NH 3 (г) + 3 O 2 (г) = 2 N 2 (г) + 6 H 2 O (г) + Q является реакцией 1) соединения, каталитической, эндотермической 2) замещения, каталитической, экзотермической 3) окислительно-восстановительной, некаталитической, экзотермической 4) обмена, некаталитической, эндотермической А2.
Увеличение давления повысит скорость химической реакции между 1) Fe и H 2 SO 4 (р-р) 2) NH 3 и O 2 3) Zn и HCl ( p - p ) 4) BaCl 2 (p-p) и H 2 SO 4 (p-p) А3. Сильными электролитами являются: 1) HCl и AgNO 3 2) Fe ( OH ) 3 и H 2 SO 4 3) Zn ( OH ) 2 и H 2 S 4) H 3 PO 4 и Ag 3 PO 4 А4. Химическое равновесие в системе CO 2 (г) + C (тв) ↔ 2CO (г) – Q сместится вправо при 1) повышении давления 2) понижении температуры 3) повышении концентрации СО 4) повышении температуры А5. В качестве анионов только гидроксид-ионы образуются при диссоциации 1) Ba(OH) 2 2) CH 3 – OH 3) (CuOH) 2 CO 3 4) HCOOH В1. Установите соответствие между реагентами и ионно-молекулярным уравнением реакции. РЕАГЕНТЫ ИОННО-МОЛЕКУЛЯРНОЕ УРАВНЕНИЕ А) NaOH + HNO 3 1) CaCO 3 + 2 H + = Ca 2+ + H 2 O + CO 2 Б ) Na 2 CO 3 + HCl 2) CO 3 2– + H 2 O = HCO 3 – + OH – В ) Na 2 CO 3 + CO 2 + H 2 O 3) OH – + H + = H 2 O Г ) CaCO 3 + HCl 4) CO 3 2– + 2H + = CO 2 + H 2 O 5) CO 3 2– + CO 2 + H 2 O = 2HCO 3 – В 2. При образовании аммиака согласно уравнению реакции: N 2 ( г) + 3 H 2 (г) = 2 NH 3 (г) + 92 кДж, выделилось 23 кДж теплоты.
При этом объём (н.у.) составил:.( Ответ округлите до целых) С1. Используя метод электронного баланса, составьте уравнение реакции: К 2 М nO 4 +НС l →М n С1 2 + С1 2 +.+. Определите окислитель и восстановитель. Вычислите объём углекислого газа, который образуется при разложении 600 г карбоната кальция, содержащего 20% примесей.
Ключи к проверке 1 вариант. Баллы 1-5 6-8 9-10 11-12 Отметка «2» «3» «4» «5» Контрольная работа № 3 по теме: « Металлы» Вариант1. Электронной конфигурации иона Mg +2 соответствует формула 1) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 2) 1 s 2 2 s 2 2 p 6 3 s 2 3 p 1 3) 1 s 2 2 s 2 2 p 6 3 s 2 c 4) 1 s 2 2 s 2 2 p 6 А2. Одинаковую степень окисления хром проявляет в соединениях: 1) С rCl 3 и CrO 3 2) K 2 CrO 4 и K 2 Cr 2 O 7 3) K 2 Cr 2 O 7 и Cr 2 S 3 4) KCrO 2 и K 2 CrO 4 А3.
Верны ли следующие суждения о промышленных способах получения металлов? В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны А4. Oснόвные свойства ослабевают в ряду веществ: 1) Li 2 O K 2 O Rb 2 O 2) Al 2 O 3 MgO Na 2 O 3) CaO MgO BeO 4) B 2 O 3 BeO Li 2 O А5.
Медь реагирует с каждым из двух веществ: 1) AgNO 3 и O 2 2) NaOH и HCl 3) Cl 2 и H 2 O 4) HNO 3 и MgCl 2 А6. Гидроксид магния можно получить реакцией ионного обмена при взаимодействии 1) хлорида магния с гидроксидом калия 3) оксида магния с гидроксидом калия 2) оксида магния с водой 4) карбоната магния с гидроксидом калия В1.
Установите соответствие между веществами, вступившими в реакцию и продуктами реакции ИСХОДНЫЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ 1) Fe + Cl 2 → а) FeCl 2 2) Cr(OH) 3 + NaOH → б ) Na 2 Cr( ОН ) 6 3) Cu(OH) 2 + NH 3 → в ) CuSO 4 + H 2 O 4) Cu + H 2 SO 4 ( конц.) → г ) FeCl 3 д ) CuSO 4 + SO 2 +H 2 O е) Cu ( NH 3 ) 4 ( OH ) 2 В2. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора. ФОРМУЛА СОЛИ ПРОДУКТ НА АНОДЕ А) Al ( NO 3 ) 3 1) H 2 Б ) LiBr 2) O 2 В ) C а (NO 3 ) 2 3)NO 2 Г) KCl 4) NO 5) Cl 2 6) Br 2 С1 Напишите уравнения реакций, с помощью которых можно осуществить превращения: Укажите условия протекания реакций С2. Вычислите массу соли, образующейся при взаимодействии 22, 4 оксида кальция с раствором, содержащим 51,2 г азотной кислоты, если известно, что выход составил 80% от теоретически возможного. Контрольная работа №3 по теме: « Металлы» Вариант 2. Какая электронная конфигурация внешнего энергетического уровня соответствует атому элемента II А группы?
1) 3 s 2 3 p 6 2) 3 s 2 3) 4 s 2 3 d 6 4) 2 s 2 2 p 6 А2. Одинаковую степень окисления хром проявляет в соединениях: 1) С rCl 3 и CrO 3 2) K 2 CrO 4 и K 2 Cr 2 O 7 3) K 2 Cr 2 O 7 и Cr 2 S 3 4) KCrO 2 и K 2 CrO 4 А3. Верны ли следующие суждения о щелочных металлах? Щелочные металлы – это серебристо-белые мягкие вещества. Щелочные металлы – это легкие и легкоплавкие металлы. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны А4.
Наиболее легко окисляется на воздухе 1) алюминий 2) магний 3) натрий 4) медь А5. В схеме превращений Х 1 Х 2 Na 2 O NaOH NaNO 3 веществами « Х 1 » и « Х 2 » могут быть соответственно 1) Na и HNO 3 2) H 2 O и NaOH 3) HNO 3 и Na 2 O 4) H 2 O и HNO 3 А6. Гидроксид алюминия реагирует с каждым из двух веществ: 1) NaOH и BaCl 2 2) KOH и HCl 3) CaSO 4 и KNO 3 4) K 2 SO 4 и NaCl В1. С оксидом хрома ( VI ) реагируют а) NaO Н б) Н Cl в) H 2 O г) SO 3 д) СаО е) Zn В2. Установите соответствие между металлом и способом его электролитического получения НАЗВАНИЕ МЕТАЛЛА ЭЛЕКТРОЛИЗ А) натрий 1) водного раствора солей Б) алюминий 2) водного раствора гидроксида В) серебро 3) расплава поваренной соли Г) медь 4) расплавленного оксида 5) раствора оксида в расплавленном криолите 6) расплавленного нитрата С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения Al → AlCl 3 → Al (ОН) 3 → Al (ОН) 2 NO 3 → Al ( NO 3 ) 3 → Al Р O 4 С2.
При взаимодействии 5 л азота с водородом образовалось 8 л аммиака (н.у.). Вычислите выход продукта реакции от теоретически возможного. Ключи к проверке 1 вариант. Объем кислорода (при н. У.), необходимый для окисления 6,4 г серы: 1) 11,2 л 2) 5,6 л 3) 2,24 л 4) 4,48 л В1. Установите соответствие между химической формулой соединения и степенью окисления фосфора в нём Формула соединения Степень окисления фосфора А) Р 2 О 5 1) +3 Б) H 3 РО 4 2) +5 В) H 3 РО 3 3) -3 Г) Са 3 Р 2 4) +1 5) - 1 6) -2 С1 Напишите уравнения реакций, с помощью которых можно осуществить превращения: Укажите условия протекания реакций.
Контрольная работа №4 по теме: « Неметаллы» Вариант 2. Среди элементов VIA группы максимальный радиус атома имеет кислород 3) теллур 3) сера 4)полоний А2. Формула высшего оксида хлора 1) С1 2 О 2) С1О 2 3) С1 2 О 5 4) С1 2 О 7 А3. Водородное соединение с ярко выраженными основными свойствами образует углерод 2)азот 3)фтор 4)кислород А4.
При нагревании кристаллического хлорида натрия с концентрированной фосфорной кислотой выделяется газ 1) SO 2 2) SO 3 3) HCl 4) Cl 2 А5. Верны ли следующие суждения о галогенах? Фтор в соединениях проявляет как положительную, так и отрицательную степень окисления. При нормальных условиях бром и йод являются жидкостями.